EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publiziert am 04.01.2022
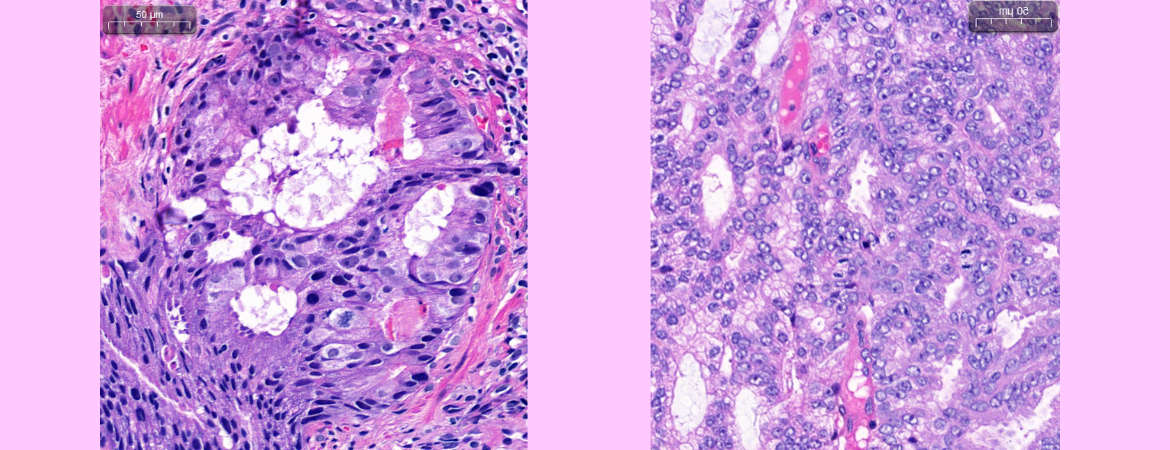
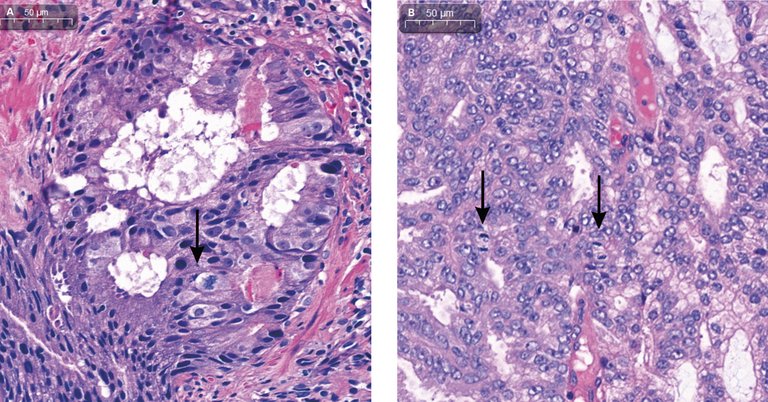
Beim Prostatakarzinom sind in den letzten Jahren grosse Fortschritte im Bereich der molekularpathologischen Charakterisierung erzielt worden, was entscheidend zur Entwicklung zielgerichteter Therapien beigetragen hat.
| Tabelle 1: Risikofaktoren für die Entwicklung eines Prostatakarzinoms. | |
| Risikofaktor | Einfluss auf Prostatakarzinomrisiko |
| Alter | <40 Jahre ist ein Prostatakarzinom sehr selten, 6/10 Fälle betreffen Männer ≥65 Jahre |
| Ethnie | Erhöhtes Risiko für People of Color |
| Geographie | Häufig: Nordamerika, Europa, Australien, Karibik Weniger häufig: Asien, Zentralamerika, Südamerika |
| Milchprodukte | Schwache Korrelation mit Einnahme von Milchprodukten und Risikoerhöhung |
| Phytoöstrogene | Möglicherweise korreliert mit niedrigerem Prostatakarzinomrisiko |
| Vitamin D | U-förmige Assoziation mit Prostatakarzinomrisiko |
| 5-Alpha-Reduktase-Inhibitoren | Reduktion des Risikos für niedrigmaligne Karzinome, aber mögliche Erhöhung des Risikos für High-Grade-Karzinome Cave: Unter 5-Alpha-Reduktase-Inhibitoren wird PSA um 50% reduziert! |
| Ejakulation | Höhere Ejakulationsfrequenz (≥21×/Monat vs. 4–7×/Monat) assoziiert mit 20%iger Risikoreduktion |
| Verwandter 1. Grades (in jeglichem Alter) | Ca. 2-fach erhöhtes Risiko |
| Verwandter 1. Grades (Diagnose mit <65 Jahren) | Ca. 3-fach erhöhtes Risiko |
| Vater und Bruder mit Prostatakarzinom | Ca. 5-fach erhöhtes Risiko |
| Zwei Brüder mit Prostatakarzinom | Ca. 7-fach erhöhtes Risiko |
| BRCA2-Mutation | 3- bis 8-fach erhöhtes Risiko |
| BRCA1-Mutation | 1- bis 3-fach erhöhtes Risiko |
| Lynch-Syndrom | 2- bis 4-fach erhöhtes Risiko |
| HOXB13 | 3- bis 8-fach erhöhtes Risiko |
| SNPs (mehr als 100 bekannt) | Risikoerhöhung für ein einzelnes SNP jeweils gering, aber kumuliert deutlich ansteigend |
| SNP: «single nucleotid polymorphism». | |
| Tabelle 2: Indikation für genetische Untersuchung bei Patienten mit Prostatakarzinom in Anlehnung an die Empfehlung des «Netzwerks für die Testung auf eine genetische Krebsprädisposition und Risikoberatung» der Schweizerischen Arbeitsgemeinschaft für klinische Krebsforschung (SAKK). | ||
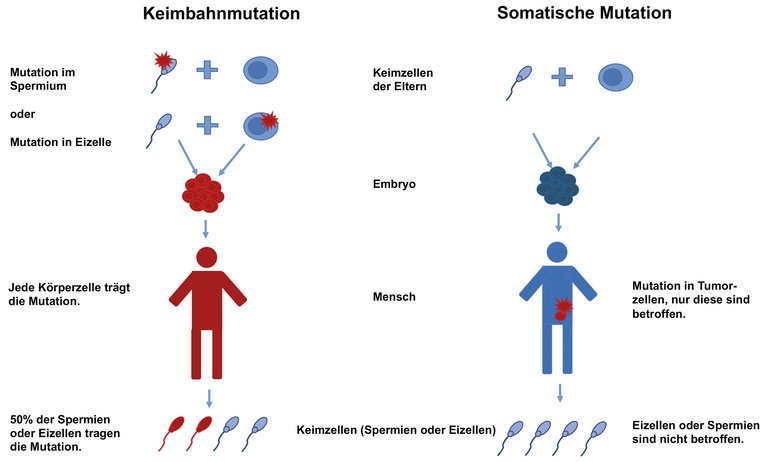
| Klinische Situation | Somatische molekularpathologische Testung | Gezielte molekulargenetische Keimbahn-Verifizierung [1] |
| Metastasiertes Prostatakarzinom inklusive histologischer Varianten (intraduktal/cribriform) | – Soll erfolgen, falls der Patient sich im Therapieverlauf für eine Therapie mit z.B. einem PARP-Inhibitor oder einem Checkpoint-Inhibitor qualifiziert. – Testung erfolgt am Tumorgewebe (evtl. in naher Zukunft auch als «Liquid Biopsy»); NGS-Panel bzgl. DNA-Reparaturgenen, DNA-Mismatch-Reparaturprotein-Genen, Mikrosatelliten-Instabilität. – Die Rate an relevanten Befunden liegt im Bereich von 15–30%. | Genetische Beratung und gezielte Mutationsanalyse soll erfolgen, falls in der somatischen Testung eine Alteration gefunden wird in BRCA1/2, ATM, PALB2, CHEK2 oder abhängig von der Konstellation in MLH1, MSH2, MSH6, PMS2 oder abhängig von Befund und auffälliger Familienanamnese. |
| Erweiterte Keimbahnuntersuchung (Panel-Testung) | ||
| Genetische Beratung und gegebenenfalls Testung: High-Grade-Prostatakarzinom (Gleason-Score ≥7) oder metastasierte Erkrankung mit – Ashkenazy-Vorfahren – >1 Person in der erstgradigen Verwandtschaft mit Brustkrebs (≤50 Jahren), Ovarial-, Pankreas- oder metastasiertem oder intraduktalem/cribriformem Prostatakarzinom – ≥2 Personen in der erstgradigen Verwandtschaft mit Brust- oder Prostatakarzinom (in jeglichem Alter) | ||
| NGS: «next generation sequencing». Für Details zur Keimbahntestung verweisen wir auf die schweizerischen Guidelines [1]: Update Swiss Guideline for counselling and testing for predisposition to breast, ovarian, pancreatic and prostate cancer. | ||
| Tabelle 3: Krebsvorsorge für Männer mit BRCA1/2-Keimbahnmutation. | ||
| Vorsorgeuntersuchung | BRCA1-Keimbahnmutation | BRCA2-Keimbahnmutation |
| Mammakarzinom | – Selbstuntersuchung der Brustdrüsen: 1× pro Monat ab 35 Jahren – Ärztliche Untersuchung der Brustdrüsen: 1× pro Jahr ab 35 Jahren – Mammographie bei Gynäkomastie: Baseline-Untersuchung mit 40 Jahren und 1× pro Jahr ab 50 Jahren | |
| Prostatakarzinom | Keine klare Empfehlung, gemeinsame Entscheidung mit betroffener Person (dann Vorgehen analog zu BRCA2): – 1× pro Jahr PSA/DRU ab 40 Jahren – MRT der Prostata bei PSA ≥2–3 μg/l | Empfohlen: – 1× pro Jahr PSA/DRU ab 40 Jahren – MRT der Prostata bei PSA ≥2–3 μg/l |
| Melanom | Generelle Empfehlungen für Hautschutz gemäss Krebsliga | – Jährliche dermatologische Kontrolle – Generelle Empfehlungen für Hautschutz gemäss Krebsliga |
| Kolonkarzinom | Kolonkarzinom-Vorsorge optional ab 40 Jahren, ab 50 Jahren gemäss allgemeiner Empfehlung | Kolonkarzinom-Vorsorge ab 50 Jahren gemäss allgemeiner Empfehlung |
| DRU: digitale rektale Untersuchung; PSA: prostataspezifisches Antigen; MRT: Magnetresonanztomographie. | ||
Veröffentlicht unter der Copyright-Lizenz.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Keine kommerzielle Weiterverwendung ohne Genehmigung.
See: emh.ch/en/emh/rights-and-licences/