EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publiziert am 11.05.2021
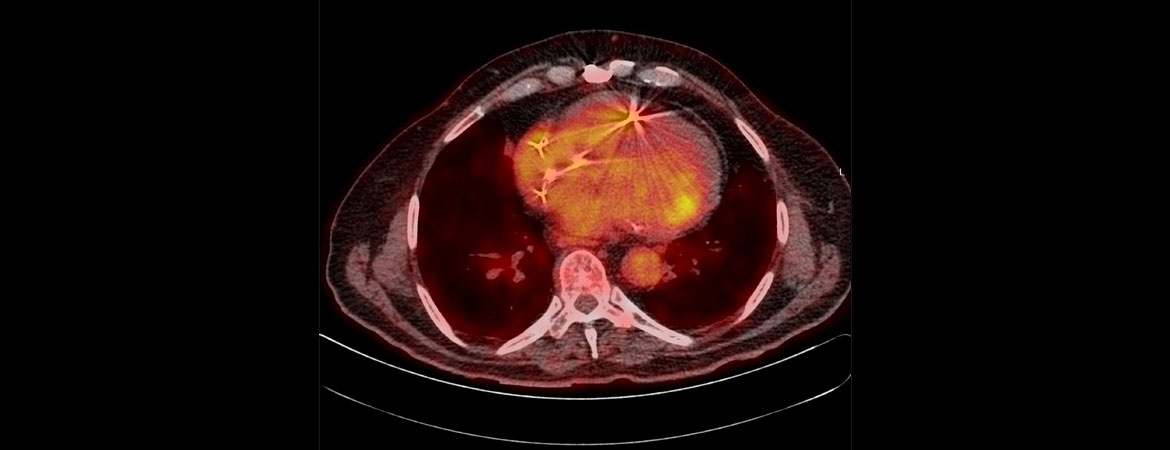
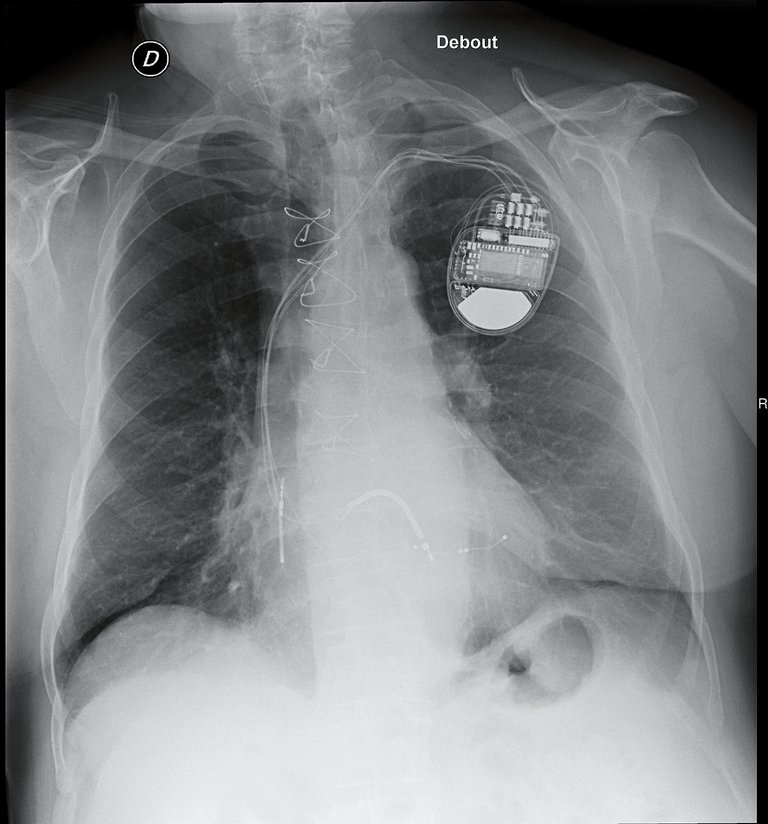
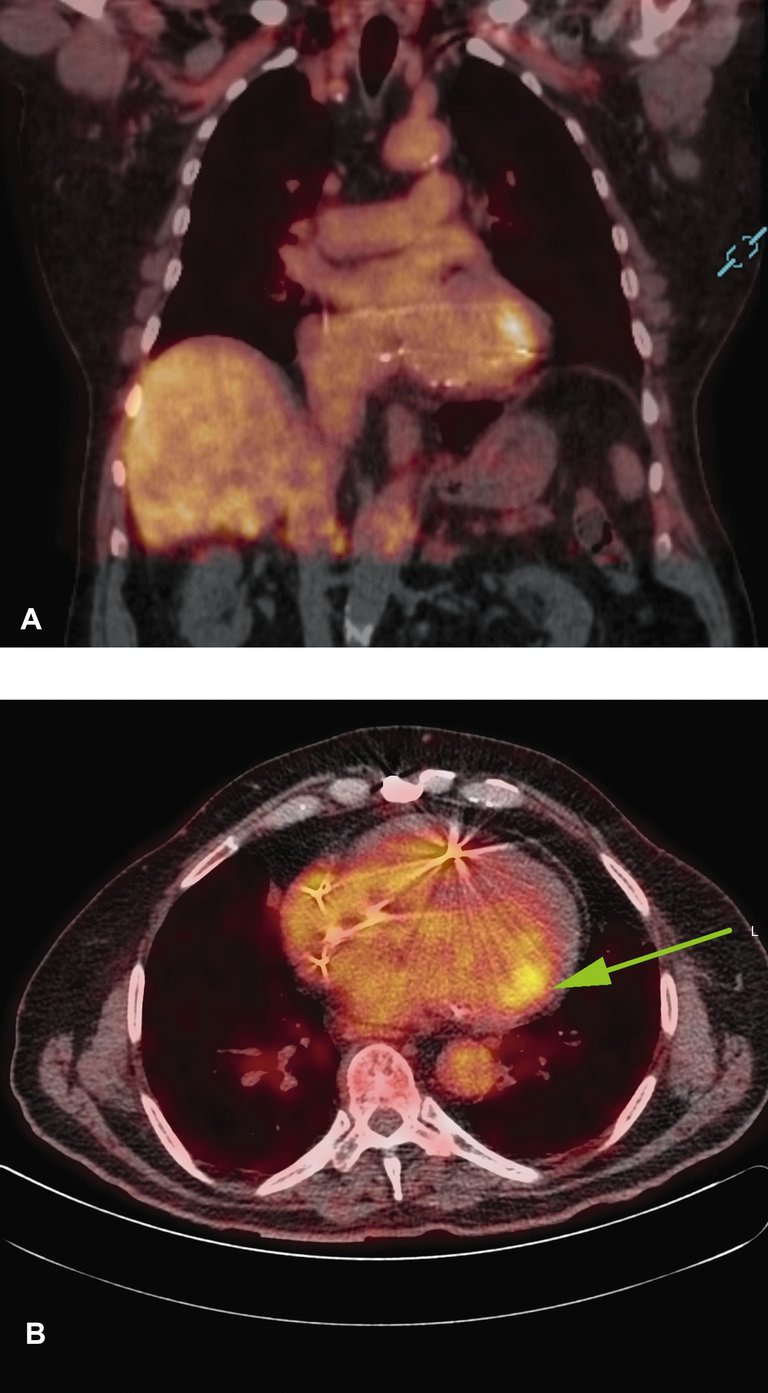
Ein 75-jähriger Patient stellt sich aufgrund zunehmender Asthenie vor. Bei ihm ist eine gemischte Kardiopathie bekannt, und er ist Träger eines CRT-Schrittmachers mit Defibrillator-Funktion.
| Tabelle 1: Klassifikation der Infektionen kardialer elektronischer Implantate («cardiac implantable electronic devices» [CIED]) und kardialer Elektroden (angepasst nach den Leitlinien von 2015 [2]). | |
| Infektion der Schrittmachertasche | |
| Unkomplizierte Tascheninfektion | Lokale Infektion ohne systematische Zeichen und Vorliegen steriler Blutkulturen. |
| Komplizierte Tascheninfektion | Nachweis einer Elektrodeninfektion, Endokarditis, systemischer Zeichen oder positiver Blutkulturen. |
| Infektion der CIED-Elektroden | |
| Gesicherte Infektion der CIED-Elektroden | Systemische Infektionszeichen /-symptome und echokardiographischer Nachweis von Vegetationen an der Elektrode und mikrobiologisches Hauptkriterium nach Duke. |
| Systemische Infektionszeichen /-symptome und positive Kultur, Histologie oder molekularer Nachweis der Infektion auf gezogener Elektrode. | |
| Mögliche Infektion der CIED-Elektroden | Systemische Infektionszeichen /-symptome und echokardiographischer Nachweis von Vegetationen an der Elektrode, aber kein mikrobiologisches Hauptkriterium nach Duke. |
| Systemische Infektionszeichen /-symptome und mikrobiologisches Hauptkriterium nach Duke, aber kein echokardiographischer Nachweis von Vegetationen an der Sonde. | |
| Tabelle 2: Risikofaktoren für eine Infektionen kardialer elektronischer Implantate («cardiac implantable electronic devices» [CIED]) (nach [4]). | ||
| Patient | Chirurgischer Eingriff | Gerät |
| • Terminale Niereninsuffizienz (OR [95% CI] = 8,73 [3,42–22,31]) • Status nach CIED-Infektion (OR = 7,84 [1,94–31,60]) • Kortikoidtherapie (OR = 3,44 [1,62–7,32]) • Niereninsuffizienz (OR = 3,02 [1,38–6,64]) • COPD (OR = 2,95 [1,78–4,90]) • Dermatologische Erkrankung (OR = 2,46 [1,04–5,80]) • Neoplasie (OR = 2,23 [1,26–3,95]) • Diabetes (OR = 2,08 [1,62–2,67]) • Herzinsuffizienz (OR = 1,65 [1,14–2,39]) • Präoperatives Fieber (OR = 4,27 [1,13–16,12]) • Antikoagulation (OR = 1,59 [1,01–2,48]) | • Dauer des Eingriffes (gewogene/gewichtete durchschnittliche Differenz = 9,89 [0,52–19,25]) • Postoperatives Hämatom (OR = 8,46 [4,01–17,86]) • Wiederholter Eingriff bei Elektrodenverlagerung (OR = 6,37 [2,93–13,82]) • Unerfahrener Operateur (OR = 2,85 -[1,23–6,58]) • Provisorischer Pacemaker (OR = 2,31 -[1,36–3,92]) • Ersatz/Revision des CIED (OR = 1,98 [1,46–2,70]) • Fehlende Antibiotikaprophylaxe (OR = 0,32 [0,18–0,55]) | • Epikardiale Elektroden (OR = 8,09 [3,46–18,92]) • Abdominale Schrittmachertasche (OR = 4,01 [2,48–6,49]) • Einsetzen von ≥2 Elektroden (OR = 2,02 [1,11–3,69]) • Doppelkammersystem (OR = 1,45 [1,02–2,05]) |
| OR: «odds ratio»; CI: «confidence intervall»; COPD: chronisch-obstruktive Lungenerkrankung. | ||
Veröffentlicht unter der Copyright-Lizenz.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Keine kommerzielle Weiterverwendung ohne Genehmigung.
See: emh.ch/en/emh/rights-and-licences/