EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publié le 01.01.2022
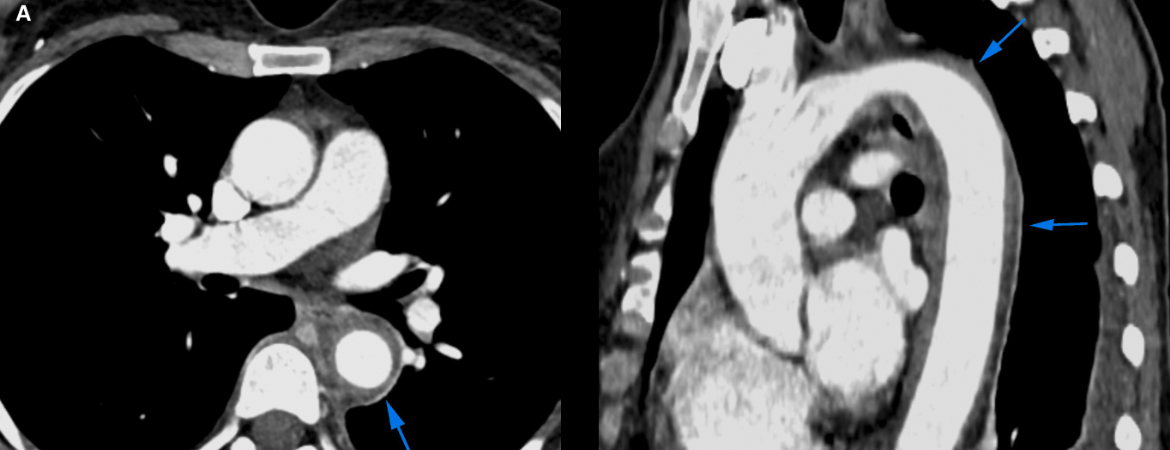
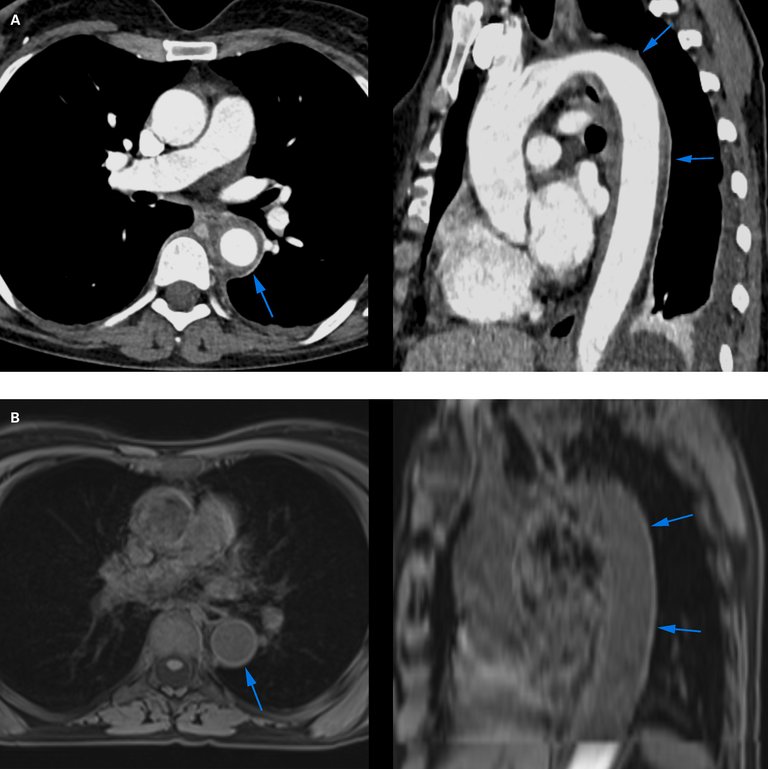
Die 60-jährige Patientin stellte sich mit seit drei Tagen zunehmendem Husten, atemabhängigen Thoraxschmerzen und Fieber vor. In der persönlichen Anamnese war ein Mammakarzinom bekannt, das vier Monate zuvor diagnostiziert wurde.
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/