EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch

Publié le 27.03.2019
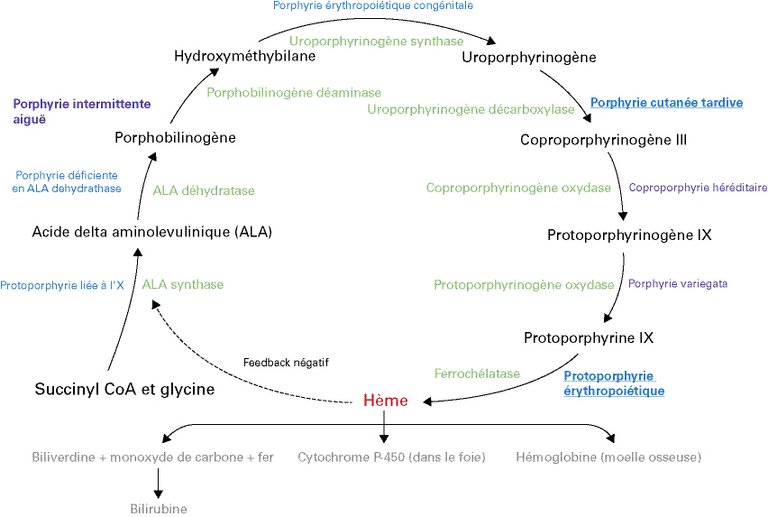
Une patiente de 43 ans consulte les urgences en raison de péjoration de lombalgies avec irradiations douloureuses dans la région sus-pubienne et vers les cuisses. Elle rapporte également la présence d’urines rouges.

| Tableau 1: Manifestations cliniques courantes lors de la crise de PA (adapté de [2]). | |
| Symptômes | Douleurs abdominales souvent sévères, mal systématisées, pouvant aussi toucher le dos, les bras et les jambes |
| Nausée, vomissement, constipation | |
| Insomnie, agitation, anxiété, confusion, psychose avec hallucinations et trouble du comportement | |
| Signes cliniques | Urine foncée ou devenant plus foncée (voir rouge-orangée) lors de l’exposition à la lumière |
| Lésions cutanées bulleuses pouvant toucher les zones photo-exposées qui sont inconstantes | |
| Hypertension, tachycardie, arythmie | |
| Neuropathie périphérique motrice. Dysphagie, rétention urinaire aiguë ou incontinence, progression possible vers la parésie flasque, ou l’insuffisance respiratoire | |
| Convulsions. | |
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/