EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publié le 27.03.2019
Nous rapportons le cas d’une femme âgée de 40 ans qui s’est en premier lieu présentée chez son médecin de famille en raison de nouvelles céphalées sévères aiguës récidivant de façon épisodique.
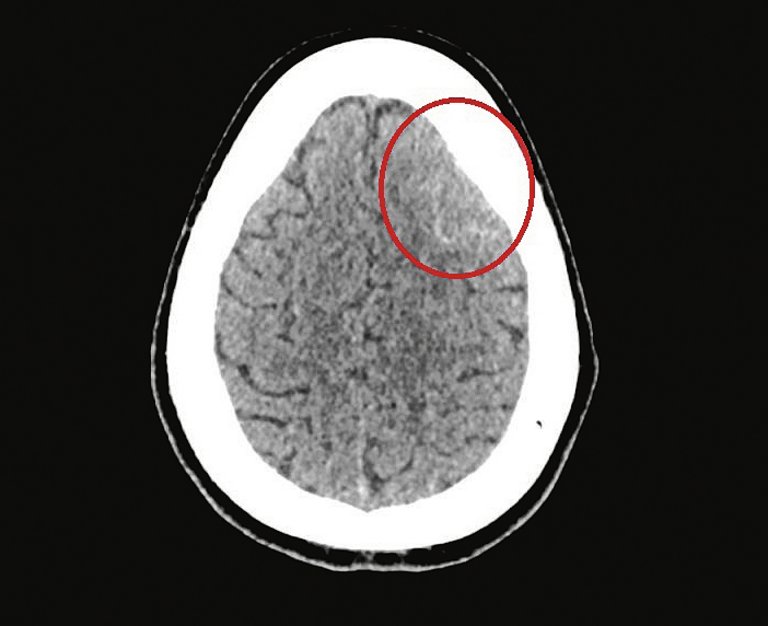
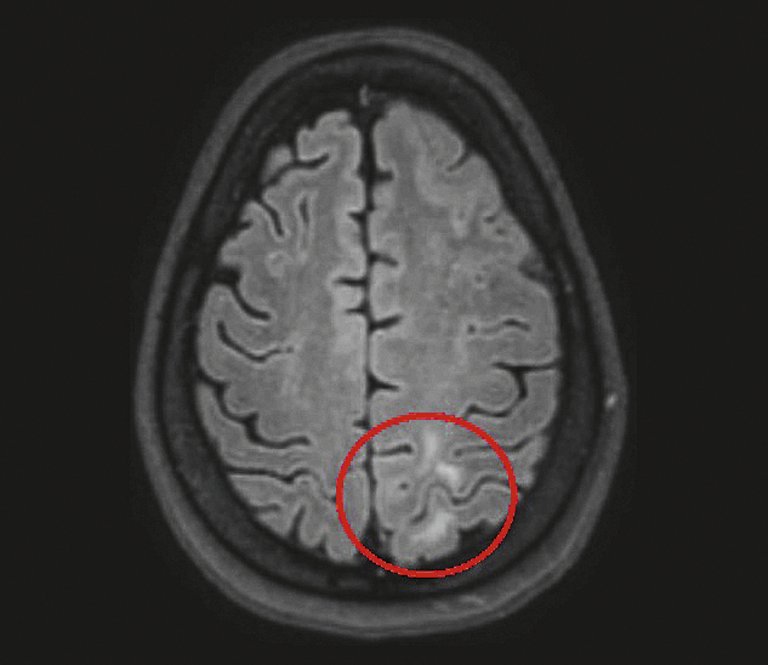
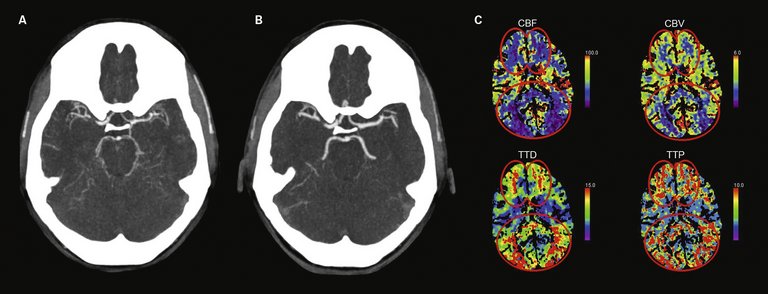
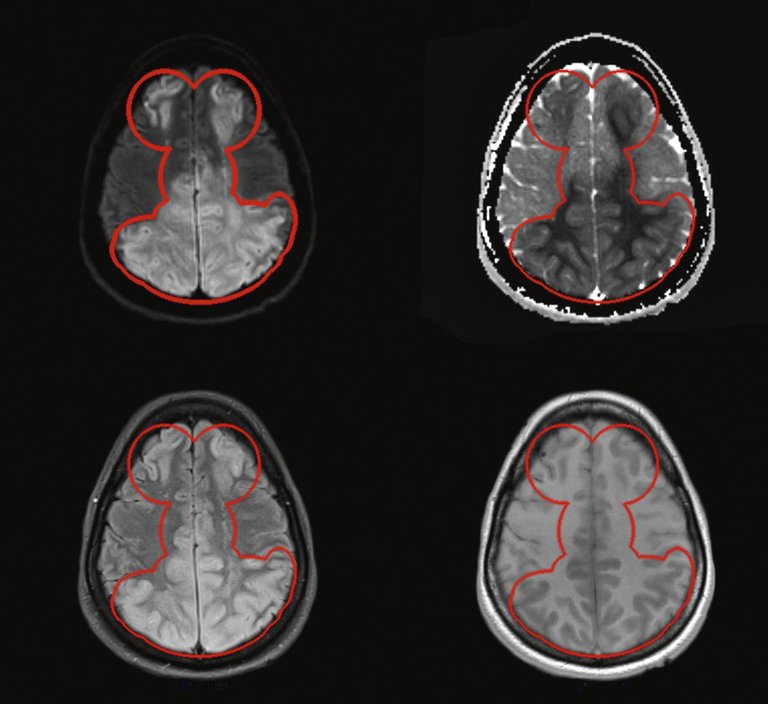
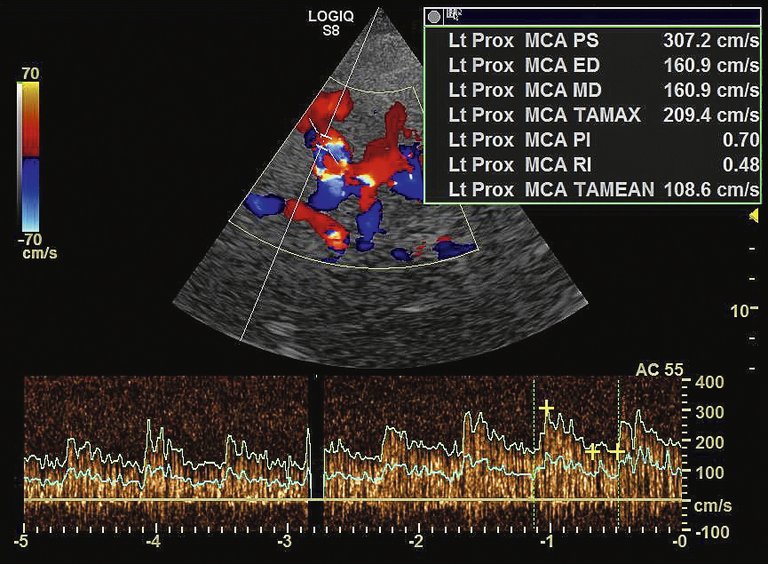
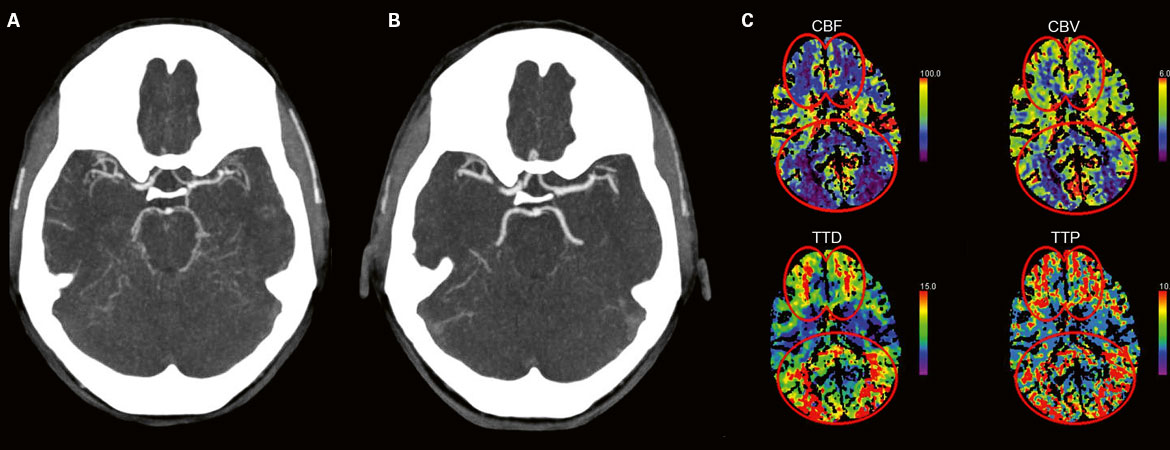
| Tableau 1: Critères diagnostiques du syndrome devasoconstriction cérébrale réversible (SVCR) (d’après [6]). Tous les critères doivent être remplis. |
| Céphalées aiguës violentes (souvent «thunderclap headache») avec/sans signes neurologiques focaux ou crises épileptiques |
| Evolution monophasique sans nouveau signe clinique après 1 mois |
| Mise en évidence d’une vasoconstriction segmentaire des artères intracérébrales au moyen de la tomodensitométrie, de l’imagerie par résonance magnétique ou de l’angiographie de soustraction digitale |
| Pas de mise en évidence d’hémorragie sous-arachnoïdienne anévrismale |
| Liquide céphalo-rachidien normal ou proche de la normale (<15 cellules/μl, protéines <100 mg/dl) |
| Régression complète ou significative de la vasoconstriction 12 semaines après le début des symptômes |
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/